12月18日,卫材株式会社(以下简称卫材)自主研发的磺酸仑伐替尼(乐卫玛®)用于肝细胞癌治疗的上市申请,获得国家食品药品监督管理总局(CFDA)优先审评审批资格。
全球范围内,仑伐替尼甲状腺癌适应证和肾细胞癌(与依维莫司5mg联用)适应证已于2014年起被美国、欧盟、日本等多个国家或地区批准。2017年10月30日,在欧盟、美国、日本递交了肝癌适应证上市申请后,中国几乎同步递交了上市申请,开我国进口药品注册之先河。仅隔2月后,申请就获得优先审评审批资格。其速度之快,体现了中国肝癌患者对仑伐替尼的需求之迫切。
CFDA改革创新,新药进口重重关卡被打破
2017年10月CFDA颁布了《国家食品药品监督管理总局关于调整进口药品注册管理有关事项的决定》(以下简称《决定》)。《决定》调整的事项主要有三个方面:
一、允许同步研发申报。根据现行《药品注册管理办法》(以下简称《注册办法》)要求,境外向总局申请开展国际多中心药物临床试验(MRCT)的药物,应当是已在境外注册或者已经进入Ⅱ期或Ⅲ期临床试验。《决定》实施后,除预防用生物制品外,允许在中国境内外同步开展Ⅰ期临床试验。
二、优化注册申报程序。《注册办法》中MRCT申报及审评审批是相对独立的程序,《决定》实施后,开展MRCT的药品申请进口,符合《注册办法》及相关文件要求的,可以直接提出进口上市注册申请。
三、取消部分进口药品在境外上市的要求。对于提出进口临床申请、进口上市申请的化学药品新药以及治疗用生物制品创新药,取消应当获得境外制药厂商所在生产国家或者地区的上市许可的要求。
解放军八一医院秦叔逵教授表示:"本次仑伐替尼获得优先审评审批资格,得益于CFDA的改革和创新意识,成为《决定》颁布以来,首个以国际多中心试验数据递交上市申请,同时又以其鼓舞人心的数据获得优先审评审批资格的产品。"
乙肝大国困境,肝癌系统性治疗手段有限
根据国家癌症中心2017发布的数据:肝癌是发病率和致死率都高居我国第三的恶性肿瘤,其中80%以上由乙肝患者演变而来。早期肝癌患者症状隐匿,多数患者确诊时已属中晚期,丧失了根治性治疗的机会,晚期肝癌患者治疗方法有限且预后差。
此前,对不可切除的晚期肝细胞癌患者一线治疗选择仅有索拉非尼,但其总有效率较低,尤其对于HBV相关的肝癌疗效较差。因此,基于中国肝癌患者在危险因素、临床表现、诊断时分期等方面的特殊性,临床急需对HBV相关肝癌疗效佳的新型药物。
仑伐替尼横空出世,为中国患者量身打造
仑伐替尼是一种独特的多靶点受体酪氨酸激酶抑制剂(VEGF受体-1,2,3;FGF受体-1,2,3,4;PDGFRα;RET和KIT)。
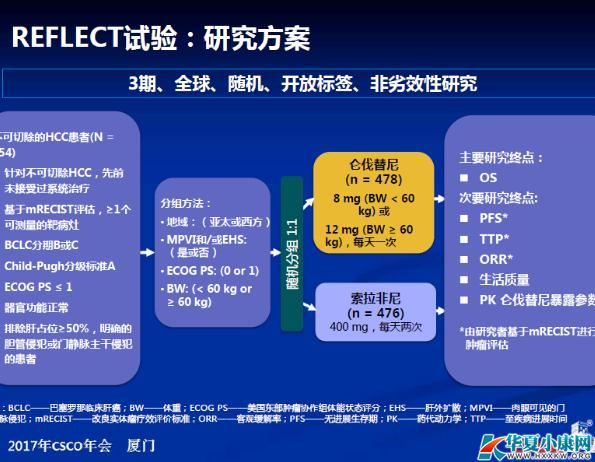
今年ASCO年会上发布了仑伐替尼对比索拉非尼一线用于不可切除的肝细胞癌的III期临床试验REFLECT研究结果。仑伐替尼组总生存期非劣效于索拉非尼(13.6个月 vs. 12.3个月,风险比(HR)为0.92,95%置信区间 [CI] = 0.79-1.06),达到研究的主要终点。
今年CSCO会议上公布了REFLECT研究中国(大陆+香港+台湾)人群亚组分析结果,数据显示:仑伐替尼与索拉非尼相比, OS显著延长4.8个月(15.0个月 vs.10.2个月)。对于合并对HBV感染的患者,仑伐替尼相比索拉非尼,OS几乎提高了50%(14.9个月 vs. 9.9个月)。
此外,仑伐替尼在中位无进展生存期(9.2个月 vs. 3.6个月)、中位疾病进展时间(11.0个月 vs. 3.7个月)和客观缓解率(21.5% vs.8.3%)三个次要研究终点方面均显著优于索拉菲尼,较索拉非尼提高了2倍以上。
与全球总人群相比,仑伐替尼在中国患者亚群中具有更加显著的疗效,更适用于中国乙肝肝癌患者,是肝癌靶向治疗的突破性药物。
结语
CFDA通过改革和创新简化了创新药物的进口审批流程,我国患者因此可以同步享受科技创新的成果。中国肝癌患者基数庞大,寻找有效治疗药物迫在眉睫。CFDA优先审评审批仑伐替尼,解肝癌患者燃眉之急,让我国乙肝肝癌患者病有所医。仑伐替尼将为中国肝癌患者带来新的生机和希望,让我们满心期待!